Nová metoda léčby rakoviny přiměje zhoubné buňky k výbuchu
Nanotechnologie společně s chytrými léčivy přináší chemoterapii a radioterapii cílící pouze na nebezpečné buňky.

Už brzy bychom se měli dočkat úspěšné léčby i té nejagresivnější rakoviny, která zároveň bude maximálně šetrná k zbytku těla. Výzkum publikovaný v časopise Nature Medicine přibližuje postup léčby vyvinutý americkou Rice University. Její terapie nese přízvisko "quadrapeutická" a kombinuje v sobě čtveřici klinicky povolených léčebných postupů v ultimativní proces, jenž slibuje vyhledávat a ničit lékům odolné rakovinové buňky a zároveň zachovat zdravou tkáň neporušenou.
Zdravá exploze
Postup byl vyvinut primárně pro léčbu nejagresivnějších druhů rakoviny, rakoviny hlavy a krku. Tyto jsou extrémně odolné vůči současné radioterapii a chemoterapii, prognóza jejich léčby proto momentálně není nejlepší. Je však kouzelné, že stejně tak by "quadrapeutika" byla využitelná i pro eliminaci komplikovaných nádorů spojených se zdravou tkání, zrovna tak jako by bylo možné ji aplikovat na jakékoliv další typy tumorů. Její principy totiž vedle možných různých typů léčení fungují na libovolné buňky. V čem však recept na její úspěch spočívá?
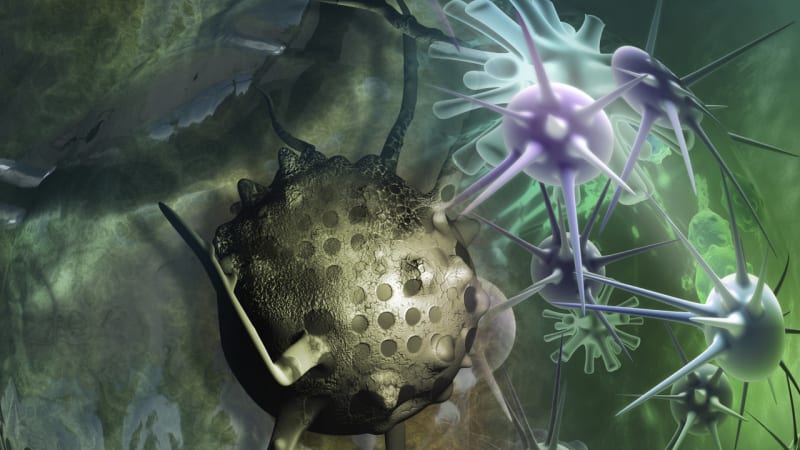
Na úvod vezměme farmaka, zlaté nanočástice, laserové záření a rentgenové paprsky. Léky zaměřené specificky proti rakovinovým buňkám jsou společně s částicemi zlata vpuštěny do těla, díky specifickým "zaměřovacím" protilátkám se však navážou pouze na konkrétní rakovinové buňky, zatímco nechávají zdravé buňky v klidu. Tyto zatím v těle zůstávají v poklidu.
Do činnosti je uvede až slabý infračervený laser, který je zaměřen na nádor a skrze slabé vypařování tekutin způsobí mechanické poškození rakovinových buněk – doslova explozi jejich membrány. Spolu s tím se zvyšuje i efektivita doručených léků. Nakonec se na nádor zaměří taktéž rentgenová radioterapie, jejíž efekt je podobně jako v případě doručených léků zesílen nanočástičemi zlata. Ve finále v sobě metoda kombinuje procesy radioterapie a chemoterapie, uvádí je však v praxi pouze lokalizovaně na specifické nádorové buňky.
"Odolné rakovinové buňky zabíjí právě spolupráce těchto komponentů a procesy, které s jejich pomocí v buňkách aktivujeme," říká autor studie Dmitri Lapotko z Rice University. Postup byl prozatím testován na myších trpících právě rakovinou hlavy a krku. Jejich nádory byly eliminovány během jediného týdne, bylo přitom třeba pouze 2–6 % léků a radioterapie v porovnání s běžnou léčbou rakoviny. Rice University momentálně spolupracuje s dalšími institucemi ve snaze rozšířit proces pro jiné druhy rakoviny a zahájit klinické testy.
S každým rokem lépe
Likvidace rakovinového nádoru pomocí nanotechnologií se sice může zdát jako exotický výstřelek vědy, ve skutečnosti je však ve fázi aplikovaného testování už několik let. Zlatým grálem výzkumu je vyvinutí pokročilých inteligentních "nanorobotů", které by jako zmenšené stroje kolovaly tělem a likvidovaly rakovinové nádory či jiná onemocnění.
K tomu by bylo třeba efektivněji ovládat pohyb nanočásic a jejich „inteligenci“. Syntetické nanomotory jsou realitou rovněž již několik let, jenom letos navíc došlo na několik podstatných pokroků. V únoru na první úspěšné testování nanomotorů uvnitř živé lidské buňky, v květnu zase vědci z Texasu vytvořili nový druh nanomotoru schopný fungovat až 15 hodin.
Na tuto pokročilou nanotechnologii aplikovanou do běžné medicíny si ještě nějaký ten pátek počkáme, neznamená to však, že by nynější léčba rakoviny pomocí nanotechnologií byla omezena pouze na likvidaci samotných nádorů. Výzkumníci se například rovněž zaměřují na efektivnější boj proti metastázovým nádorovým buňkám kolujícím v těle. Inteligentní metody doručení léků rovněž spoléhají na schopnost nanočástic vyhledávat specifické rakovinové buňky, například skrze zaměření se na jejich unikátní protein. Do svého cíle by pak tito titěrní přepravci mohli doručit tradiční medicínu jako v případě quadrapeutiky.
Vedle nanotechnologie však výrazný pokrok slibuje i genové inženýrství – zde vévodé překalibrování samotného imunitního systému pacienta k cílení na proteiny rakovinových buněk. Tento postup v několika zámořských nemocnicích již prochází klinickými testy na lidech, jeho výhodou je především možnost zachránit většinu pacientů i v pozdní až terminální fázi onemocnění. Prozatím má však nevýhodu v možnosti léčit pouze některé typy zhoubných nádorů, například rakovinu kůže.
Ladislav Loukota