Genový editor CRISPR se nyní může svést i na nanočásticích
CRISPR je nyní ještě mocnější než dříve. Ve hře jsou i nanočástice, ale kdy se dočkáme reálné léčby?

Letošní rok pokračoval v nastoleném trendu průlomových využití editace DNA. Od rakoviny po dědičné choroby vědci byli s to léčit nejrůznější doposud nepředstavitelné nemoci - povětšinou na zvířatech, někdy však i u lidí. Nejnovějším průlomem je pak spojení editoru CRISPR a nanotechnologií.
Surfovat na nanočásticích
Technologie editoru CRISPR je překvapivě jednoduchá - zahrnuje naváděcí část RNA, která se váže na cílenou DNA sekvenci, a enzym (nukleázu Cas9), která jako nůžky může vystřihnout či naopak vložit požadovanou informaci do genomu. CRISPR již zjednodušil způsob, jakým nahlížíme na teoretické studium DNA a dědičných nemocí. Zároveň však také zlevnil genovou editaci do takové míry, že dnes s CRISPRem pracuje každý druhý student daných oborů. Metoda se však, zdá se, stále teprve zahřívá ke skutečným "zázrakům".
Nejnověji se začala možná přepisovat i metoda, jakou je CRISPR uvnitř lidského těla šířen. Tradiční metody pro editaci DNA spoléhají ve virový vektor jako šiřitele editace - neškodný virus je při této metodě jakýmsi dopravním prostředkem pro nástroje CRISPRu. Problém této metody je však skutečnost, že je hůře aplikovatelná mimo nemoci svalstva a krve. Pro aplikaci hlouběji v lidském těle může být genová editace překvapivě náročná.
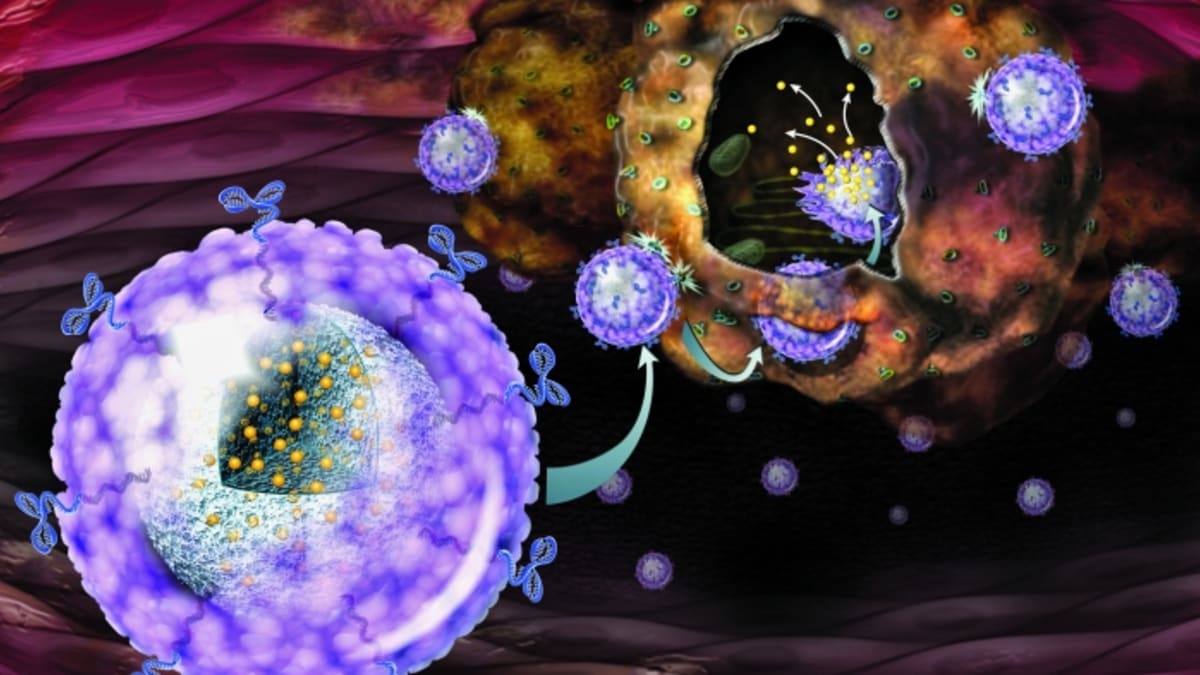
Tým doktora Hao Yin z Massachusettského technologického institutu přišel s nápadem na alternativní využití nanočástic, které by mohly sloužit jako nový dopravní prostředek CRISPRu. Na přelomu listopadu a prosince vědci konečně dosáhli průlomu, kdy vytvořili systém nanočástic, které uzavřely komponenty CRISPRu do ochranného obalu. Částice se pak mohou pomocí jednoduchého vpichu a navigování nanočástic uvnitř těla pomocí vnějších magnetických polí dostat do požadované lokace.
Yinův tým takto ilustroval úspěšnou editaci 80 procent buněk jater - podařilo se jim při tom eliminovat nežádoucí gen způsobujících genovou poruchu při zpracování cholesterolu a vyléčit tak skupinu testovaných myší s chorobou. To celé bez využití virů a při aplikaci na již žijící jedince. "Pokud lze reprogramovat DNA vašich jater, zatímco je používáte, myslíme si, že by danou metodou bylo možné léčit celou řadu onemocnění," sdělil vedoucí dané studie Daniel Anderson.
2018: Rok CRISPRu?
Nejednoho čtenáře však při čtení odstavců výše napadalo, proč jsme se vlastně tak geniálního nástroje ještě nedočkali v praktické medicíně? Skutečnost je však taková, že genové terapie letos učinily obrovský skok kupředu, skoro stejně tak velký jako loni. Zatímco v roce 2016 se CRISPR již začal klinicky testovat na lidech - v USA i Číně proběhly pokusy s jeho pomocí již léčit rakovinu - v roce 2017 byly hned dvě genové terapie (ačkoliv nevyužívající přímo CRISPRu) schváleny pro plošné použití .
Vědci navíc poskočili i experimentální využívání CRISPRu. Ačkoliv na jaře proběhla éterem studie varující, že editor způsobuje mnohem více neplánovaných mutací, než se vědci domnívali, práce byla později vyvrácena pro nepřesnou metodiku. Naopak se na podzim genové inženýři pochlubili přesnější metodou CRISPR 2.0, která umí upravovat ještě menší kusy genových vět než dříve. I letos jsme se přitom dočkali dechberoucího průlomu.
Měníme lidský genom
Když se v posledních letech mluvilo o úpravě genomu člověka, myšleny tím byly dva postupy. Genové editace se zkusmo buďto prováděly buďto na nikdy nevzešlých lidských plodech (obvykle se sestávajících z jedné či několika buněk), či probíhaly nepřímo skrze odběr buněk pacienta, jejich "externí" úpravu a poté vrácení do těla pacienta. Letos však vědci zcela poprvé sáhli po editaci genomu in vivo, tedy uvnitř pacienta.
Právě to je zároveň odpovědí na otázku, kdy se CRISPRu a jemu podobných terapií dočkáme masověji i u nás - zatímco dosavadní terapie obvykle stála a padala na relativně dražší úpravě mimo tělo, pokud se prokáže bezpečnost úprav genomu přímo uvnitř pacienta, mohlo by to znamenat průlom v dostatečně levné genové terapii pro široké využití. Například první terapie schválená FDA pro širokou léčbu vyjde jednoho pacienta skoro na 10 milionů korun - nejde tedy ani tak o to, že bychom se genové léčby nemohli dočkat. Prozatím je však příliš neozkoušená, příliš limitovaná i příliš drahá. I tak je však v přípravě dalších 20 klinických studií podobného ražení.
Uvážíme-li však, že CRISPR je zde teprve od roku 2012 a jemu podobné metody občas i méně, je tempo jejich růstu přesto ohromující. Vize na radikální zlevnění terapií v dohledné době mohou být příliš optimistické - i tak lze ale říct, že bude-li tempo růstu nových terapií příští rok pokračovat v trendu posledních dvou let, rok 2018 by mohl pro praktické uplatnění CRISPRu být průlomový.